USA : l’ECG de la douleur thoracique aux Urgences prend un coup de jeune
Journal Club n°30<br>Quand des urgentistes intègrent – enfin – le panel d'experts chargé de rédiger les nouvelles guidelines sur la prise en charge de la douleur thoracique aux Urgences, forcément, on a envie d'y jeter un oeil... (spoil : ça valait le coup).
Nous publions ici, avec son accord, le Journal Club que le Pr Nicolas Peschanski * propose à ses étudiant.e.s afin de leur présenter certaines études relatives à sa spécialité. Nous l'en remercions chaleureusement.
Journal Club n°30
Dans le cadre de cette série de Journal Club, je m’attelle rarement aux fameuses “guidelines” qui sont autant de directives importantes pour le cadre de nos pratiques. En effet, dans mes domaines de prédilection comme la cardiologie d’urgence, je suis souvent déçu de voir que les urgentistes sont rares, voire absents, du panel d’experts qui rédigent ces guidelines.
C’est particulièrement vrai pour l’European Society of Cardiology (ESC) qui en compte…zéro. C’est en partie le cas pour l’American Heart Association/American College of Cardiology (AHA/ACC) qui n’en comptait qu'un seul jusqu’alors. Pour les guidelines de 2022, ce nombre a été doublé. Une bonne raison pour moi de me pencher avec intérêt sur le dernier consensus d’experts publié dans le Journal of the American College of Cardiology portant sur la filière de prise en charge de la douleur thoracique aux urgences.
Raison supplémentaire : les auteurs sont trois de mes amis, deux urgentistes américains et un cardiologue interventionnel turc (Steven Smith et Pendell Meyers de Minneapolis, et Emre Aslanger, qui exerce à Istanbul).
Introduction
Au départ, je n’étais pas persuadé que ces nouvelles directives de l'American College of Cardiology atteignent un tel niveau de nouveautés pertinentes. Mais, comme à mon habitudHee quand cela concerne l’électrocardiogramme, j’ai bondi sur l’opportunité de les parcourir.
Ces nouveautés concernent les infarctus occlus sans les aspects «typiques» de syndrome coronarien aigu (SCA) avec sus-décalage du segment ST. Certains collègues les nomment «équivalents ST+» afin de refléter un changement de paradigme émergent depuis plusieurs années. En effet, les évidences scientifiques se multiplient en faveur de cette nouvelle définition des infarctus du myocarde occlus (IMO) avec ou sans surélévation du segment ST.1,2
Finalement, l’analyse critique de ces directives s’est avérée bien plus riche que prévu. Le point à retenir absolument, c’est que pour la première fois les cardiologues reconnaissent de multiples équivalents au fameux syndrome coronarien avec sus-décalage du segment ST (SCA ST+).3 Ces aspects ECG (ou “patterns”) doivent donc être connus, et donner lieu aux mêmes traitements que celui-ci.
Quelques autres points méritent d’être soulignés et peuvent nous être sacrément utiles – que l’on soit urgentiste ou cardiologue – et in fine aux patients.
Un regard plus objectif sur la sémiologie de la douleur thoracique
La première information notable, c’est la suppression progressive de la terminologie «douleur thoracique atypique», sorte de fourre-tout où se retrouvaient pêle-mêle la douleur thoracique féminine, celle des personnes âgées ou encore toute douleur thoracique ne correspondant pas à la sacro-sainte douleur médio sternale constrictive.
Autant être clair, j’abonde en faveur de la suggestion faite par l’AHA d’utiliser les terminologies «douleur thoracique cardiaque», «possiblement cardiaque» et «non cardiaque» – en fonction de l’évaluation anamnestique – à la place des termes «typique» et «atypique».
Je persiste à croire que cette dichotomie entre «typique» et «atypique» est stupide, tant il est évident que la proportion d’occlusions coronaires se présentant avec une douleur «typique» est relativement faible. À ce sujet, je vous renvoie à l’article de synthèse d’une excellente série de sémiologie clinique du JAMA publié il y a quelques années.4
Une place confortée de l’interaction médecin-patient
Dans la section des hypothèses, les auteurs évoquent les notions de filière de soin, de démarche de raisonnement clinique et de décision. Cette approche correspond à la réalité de notre pratique. En particulier, ils insistent sur le fait que la stratification du risque d’occlusion coronaire devant une douleur thoracique doit être interprétée dans le contexte de toutes les informations cliniques disponibles. Le jugement clinique du médecin au chevet du patient reste indispensable, là où l’utilisation d’un outil d’aide à la décision ou d’un score peuvent conduire à une stratification différente.
J’apprécie de voir apparaître dans des recommandations un chapitre qui se rapporte à l’art de pratiquer la médecine, même si le jugement clinique peut être lui aussi pris en défaut. En d’autres termes, devant une douleur thoracique, vous devez toujours avoir un raisonnement clinique et parfois passer outre les scores d’aide à la décision.
Halte à la « troponinite aiguë ! »
Une troponinémie supérieure au seuil de «positivité» n’est certes jamais normale. Pour autant, l’étiologie n’est pas toujours un syndrome coronarien aigu. Encore une fois, nous devons rester avant tout des médecins.
Même si la définition universelle de l’infarctus a rebattu les cartes depuis l’an 2000 et qu’elle est régulièrement mise à jour (nous en sommes à sa 4e version), le SCA n’est pas diagnostiqué uniquement sur la base du dosage de la troponine5, mais à partir de l’anamnèse et de l’examen clinique – éléments essentiels au diagnostic – complétés par une combinaison d’examens.
Il n’en reste pas moins qu’une troponinémie élevée, si elle n’indique pas forcément un SCA et encore moins une occlusion coronaire, est associée à un mauvais pronostic quelle que soit la pathologie sous-jacente, cardiaque ou non.
Depuis l’avènement des dosages hypersensibles de troponine (c’est bien le dosage qui est plus sensible et non la molécule, elle n’a pas changé depuis des millénaires dans l’espèce humaine !), des élévations mêmes mineures semblent confirmer cet intérêt pronostique pour les patients des Urgences dont on a écarté la possibilité d’un infarctus occlus ou non.
Le corollaire est donc que, sur la base des données actuelles de la science, aucun niveau de troponinémie au-dessus du seuil de détection ne peut être considéré comme entièrement «normal».
En outre, plus la valeur de troponinémie est élevée, plus il est probable qu’elle soit liée à une souffrance myocardique, donc de SCA. Pour autant, compte-tenu d’un chevauchement important entre ces valeurs, il n’existe pas de valeur seuil permettant de distinguer un infarctus de type 1, de type 2 ou encore des lésions myocardiques aiguës d’autres origines.
Par conséquent, même les valeurs de troponinémie, normales ou anormales, doivent être interprétées au regard du contexte clinique.
Toujours concernant les dosages de troponinémie, un autre point est abordé dans ces recommandations : nous devrions utiliser des méthodes de dosage dont les seuils sont adaptés à l'âge et au sexe.
En effet, les taux de troponine sont plus élevés chez les hommes que chez les femmes et augmentent avec l'âge dans les deux sexes, même après avoir exclu les personnes présentant une cardiopathie structurelle.
En outre, l’utilisation de standards biochimiques uniformes pour déterminer le 99e percentile (soit une valeur normale de troponinémie chez 99% des membres d’une population de sujets sains) entraîne une diminution de la sensibilité et de la valeur prédictive négative (VPN) chez les femmes. Ceci contribue à un biais de genre avec un possible sous-diagnostic des femmes présentant un SCA. L’utilisation de seuils spécifiques par genre peut remédier à cette problématique.
Patients à faible risque : les scores ne sont pas la panacée
Je n’utilise pas le score HEART, même si je lui reconnais le mérite d’avoir été le premier développé et validé sur une population de patients des Urgences et non de cardiologie. C’est également le plus communément admis et diffusé dans le monde de l’urgence.
Cependant, l’absence de pondération entre les différents items de ce score me semble entraîner des biais susceptibles d’avoir des conséquences en termes de sur-diagnostic (comme pour les troponines élevées quand l’étiologie est non cardiaque). Le corollaire, c’est une augmentation significative des admissions inutiles.
Des risques de sous-diagnostics dus à la méconnaissance de certains aspects ECG sont aussi évoqués dans ces recommandations. Leur reconnaissance permettrait de renforcer le poids de l’ECG dans la démarche diagnostique ainsi que dans les scores de risques tels que le HEART (en faisant basculer cet item de la valeur 2 : repolarisation atypique - à la valeur 3 : tracé de SCA/IMO).
En fait, l’ECG et les dosages de troponine seuls sont plus que suffisants pour la grande majorité des patients. Les recommandations sont claires : les patients qui présentent un ECG initial non ischémique et dont le ou les dosages hyper/ultrasensibles de troponine excluent le risque d’ischémie myocardique peuvent être autorisés à sortir sans autre test en urgence. Ils ne nécessitent pas l’application de scores de risque.
En effet, des essais cliniques randomisés récents ont démontré l’innocuité et l’efficacité des algorithmes ESC/AHA, de l’algorithme HIGH-STEACS ou des algorithmes d’exclusion par un seul dosage de troponine inférieur au seuil de détection. Or ces essais n’imposaient pas l’utilisation de scores de risque pour identifier les patients à faible risque ; ils ont permis d’exclure plus de patients qu’à l’aide de l’utilisation d’un score.6,7
Cependant, bien que l’application systématique des scores de risque pour les patients identifiés comme à faible risque par ces différents algorithmes décisionnels ne soit pas recommandée spécifiquement dans ces recommandations, les scores HEART (récemment modifié et adapté avec l’avènement des dosages hypersensibles) ou EDACS peuvent être envisagés.
C’est notamment le cas quand le médecin estime que le patient peut être à plus haut risque, sur la base de son histoire clinique ou de ses symptômes à la présentation.
L’intérêt du raisonnement clinique à partir des biomarqueurs
Chacun sait que le SCA peut être exclu avec un seul dosage de troponine, a fortiori de haute sensibilité, chez de nombreux patients. Cela concerne environ 25 à 50% des patients souffrant de douleurs thoraciques.
En effet, l’élimination immédiate du risque de SCA est possible chez ceux dont la troponinémie est indétectable (inférieure au seuil de détection par le kit de dosage) ou très faible (très inférieure au seuil de positivité du kit). Condition sine qua non : il faut que les symptômes aient commencé au moins 3 heures avant la mesure de la troponinémie (c’est la règle « H0 à H+3 de la douleur »).
Concernant les dosages séquentiels de troponinémie pour déterminer la cinétique d’augmentation (ou de baisse, qu’on oublie trop souvent), ils doivent s’inscrire dans une démarche de décision clinique utilisant soit des dosages de troponines à haute sensibilité à 0 et 1 heure (stratégie H0-H1), soit à 0 et 2 heures (stratégie H0-H2).
Je ne discuterai pas ici de la stratégie H0-H1 de l’ESC, que je ne trouve pas adaptée à la vraie vie (surtout aux Urgences) et dont la critique fera l’objet d’un prochain journal club.6
Cependant, les approches proposées par l’ESC concernant les délais entre les dosages H0-H1 (ou H0-H2) ou par l’étude High-STEACS 9 permettent de penser qu’on peut raisonnablement abandonner les dosages à H0-H3 qui restent néanmoins présents comme alternative possible dans les recommandations.
En effet, les comparaisons directes entre ces trois délais de cinétique démontrent à la fois une plus grande efficacité (plus de patients exclus) et une plus grande sécurité (moins de faux négatifs, c’est-à-dire de SCA manqués) pour H0-H1 et H0-H2.
Ainsi, pour obtenir une performance optimale, le choix du protocole de dosage cinétique de troponinémie devrait dépendre de votre filière de prise en charge : urgentistes (stratification initiale du risque), biochimistes (délais de rendu du résultat en fonction de la durée de l’analyse) et cardiologues.
En résumé : les meilleures recommandations seraient de n’appliquer les protocoles d’évaluation du risque de SCA qu’aux patients qui présentent effectivement un certain risque de SCA.
Arrêtons les tests inutiles chez les patients à faible risque immédiat
Les patients à faible risque n'ont pas besoin de tests supplémentaires lorsque l’évaluation clinique et le dosage des biomarqueurs, basé sur une technique à sensibilité augmentée de troponinémie, écartent l’hypothèse d’un SCA.
Les auteurs des directives de l’AHA de 2022 estiment que ces patients à faible risque peuvent généralement sortir directement des urgences sans tests supplémentaires, même s’ils peuvent être envisagés en ambulatoire dans certains cas. Il s’agit pour l’essentiel d’une réitération des directives de 2021 8, mais le message est encore plus clair.
Contrairement à ce qui se pratique en Amérique du Nord, les tests supplémentaires comme l’épreuve d’effort ou le coroscanner sont rarement demandés dans les services d’urgence européens. La médecine fondée sur les preuves a déjà montré que de tels tests ne devraient pas être prescrits aux urgences mais uniquement dans une filière de soins ambulatoires organisée.
Rejoignant les recommandations européennes, ces directives 2022 de l’AHA incitent donc clairement les urgentistes américains à revoir leurs pratiques. Cela semble d’autant plus pertinent que la rentabilité des tests d’effort est faible lorsqu’ils sont effectués sur une population de patients des urgences.
En effet, peu de patients chez qui l’ECG et la cinétique de troponinémie à haute sensibilité sont normaux devraient être éligibles à ces examens supplémentaires. Dans l’immense majorité des cas, les examens réalisés aux Urgences ont permis d’éliminer une cause cardiaque à leur douleur thoracique. Les envoyer passer ces tests cardiaques est néfaste pour deux raisons : le nombre massif de faux positifs et le retard pris dans la recherche du véritable diagnostic.
Cependant, ces recommandations ne remettent pas en cause l’intérêt du coroscanner à partir des urgences pour les patients à risque intermédiaire. Cela m’interroge. En effet, les hypothèses des auteurs sur l’indication à un coroscanner en urgence m’apparaissent infondées (mais je ne suis pas cardiologue...).
Ce point particulier sape en quelque sorte la crédibilité de l’ensemble de ce chapitre des directives. Si le coroscanner est un outil important pour l’évaluation des patients à risque intermédiaire, annoncer qu’il est recommandé à la fois d’y avoir plus largement recours depuis les urgences et d’en accroître la disponibilité dans tous les centres hospitaliers me semble excessif.
En effet, les données de la science semblent indiquer :
- que la réalisation systématique d’un coroscanner à partir des Urgences n’apporte aucun avantage en termes de décès, de nombre d’infarctus ou d’évènements cardiovasculaires,
- qu’elle entraîne un préjudice évident lié à une augmentation des procédures invasives.9
C’est là où l’urgentiste que je suis se désolidarise des recommandations émises par des cardiologues, dans la mesure où elles ne me semblent pas adaptées à nos filières de prise en charge de la douleur thoracique.
En effet, ces experts affirment que l’utilisation de l’angioscanner coronaire chez les patients présentant une douleur thoracique aiguë est soutenue par de nombreux essais cliniques randomisés (portant essentiellement sur des populations de patients sans risque élevé et sans antécédents de coronaropathie, mais incluant une très faible proportion de patients des urgences).
Or, la seule citation fournie est une lettre à l’éditeur, ce qui me semble pour le moins «cavalier». Pour une publication de cet ordre, revue par les pairs et diffusée dans une grande revue de cardiologie, c’est plutôt déroutant.
Alors que l’ensemble de ces directives me semble plutôt intéressant, équilibré et proche de nos pratiques tant en médecine d’urgence qu’en cardiologie, ce chapitre en particulier écorne ma confiance… envers des recommandations rédigées principalement par des cardiologues.
Changement de paradigme : l’occlusion coronaire ne se limite pas au SCA ST+ !
Il s’agit là de l’apport majeur de ces recommandations : l’électrocardiogramme du SCA entre dans l’ère moderne ! Mais commençons par les choses «qui fâchent»… Dans ces recommandations, on trouve en effet une des choses les plus déconnectées de la réalité que j’ai jamais observée.
Les auteurs suggèrent que, pour être inclus dans une démarche d’évaluation de la douleur thoracique, le patient dispose d’un ECG 12 dérivations «non ischémique» de référence. Or, jusqu’alors, jamais les études n’ont explicitement défini l’intérêt d’un ECG 12 dérivations de référence hors ischémie myocardique supposée. On marche sur la tête… Sans oublier qu’en tant qu’urgentistes, il est déjà rarissime que nous disposions d’un ECG de référence même chez un patient ayant déjà présenté un infarctus.
Maintenant, la grande avancée de ces recommandations : Aller au-delà du SCA ST+ sur l’ECG ! Je pense que c’est la section ECG la plus importante de ce document et probablement la seule qui peut changer la pratique pour la plupart d’entre nous. En effet, contrairement aux recommandations précédentes de l’AHA 8 ou de l’ESC 6, le document mentionne spécifiquement les «équivalents ECG de SCA ST+.» 3
C'est une aide considérable car la communauté des urgentistes sait depuis longtemps que de nombreuses occlusions coronaires aiguës ne correspondent pas aux schémas ECG classiques du SCA ST+.
Les auteurs précisent qu’en l’absence d'un sus-décalage ischémique du segment ST, l’ECG doit être examiné à la recherche d’autres modifications qui ont été associées à une occlusion coronaire (voir tableau). Lorsqu’elles sont présentes, de telles modifications doivent inciter à réaliser une coronarographie en urgence (donc faire comme pour le SCA ST+).
Les modifications de l’ECG d’équivalents SCA ST+ sont les suivantes :
- SCA postérieur,
- Critères de Sgarbossa dans les blocs de branche gauche et les rythmes électro-entrainés (Pacemaker),
- Complexes de De Winter et ondes T hyperaiguës.
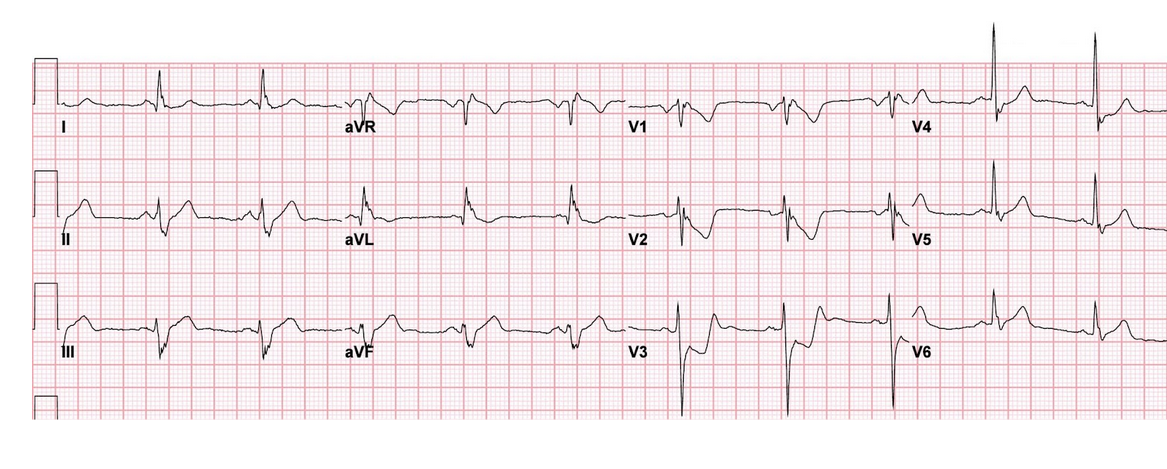
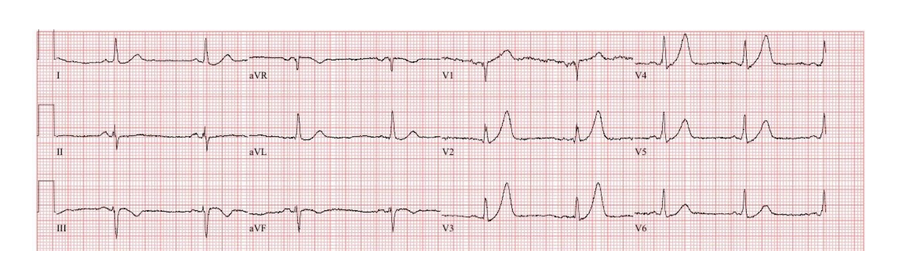
ECG 1 : infarctus postérieur par occlusion de l’artère circonflexe
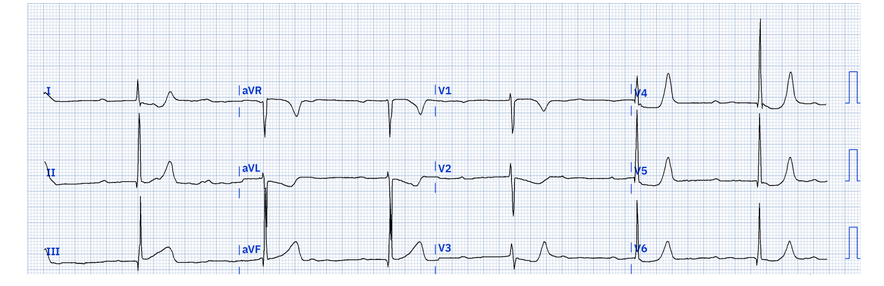
ECG 2 : infarctus inférieur aigu en présence d’un bloc de branche gauche
(1er critère de Sgarbossa avec concordance positive en DII, DIII, aVF et miroir en DI, aVL)
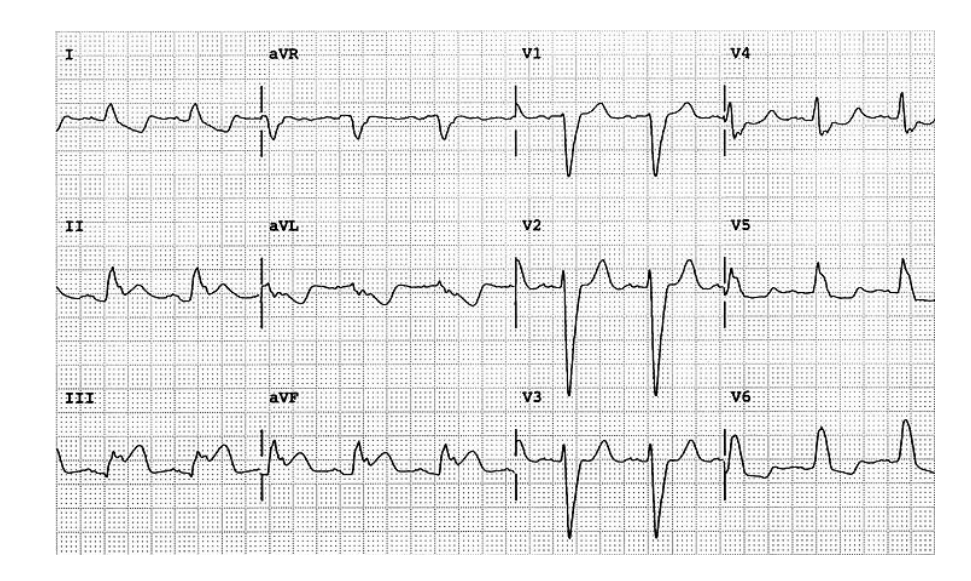
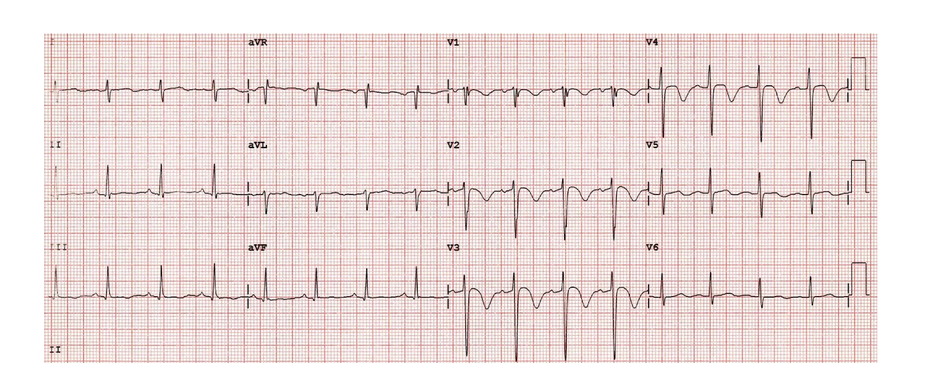
ECG 3 : infarctus antérieur aigu en présence d’un bloc de branche gauche
(3e critère de Sgarbossa modifié par Smith)
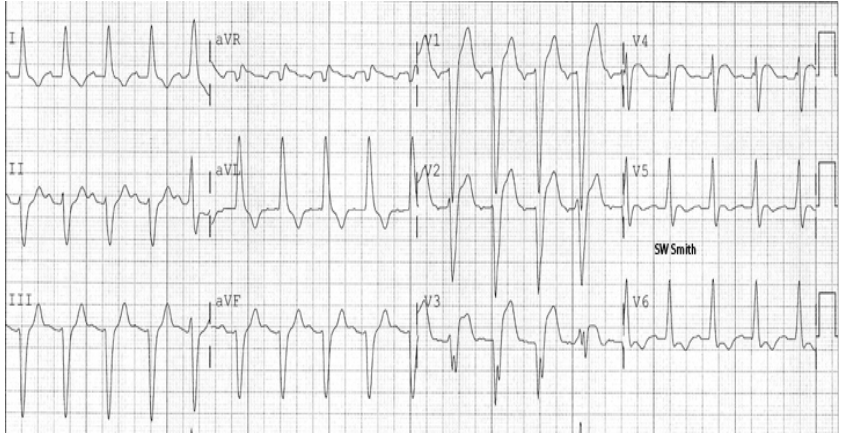
ECG 4 : Complexes de De Winter
(occlusion de l’artère interventriculaire antérieure)
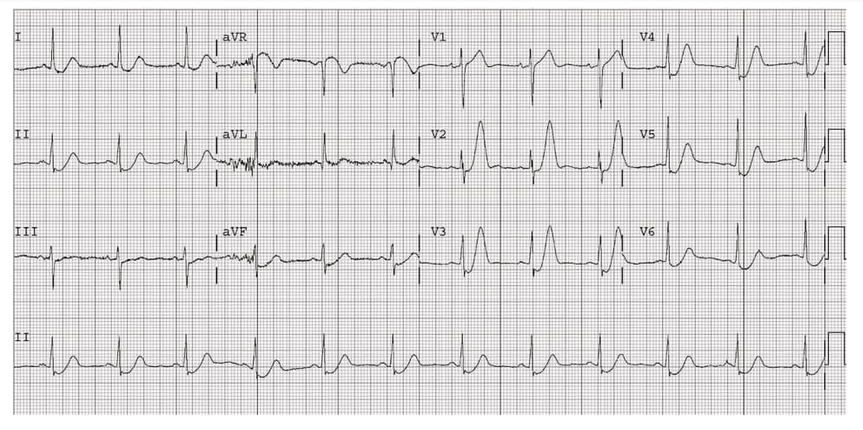
ECG 5 : ondes T hyperaiguës par occlusion de l’artère interventriculaire antérieur
Si vous avez besoin d’exemples de ces aspects ECG, je vous suggère vivement le blog du Dr Steven Smith : Dr Smith’s ECG Blog.
En outre, et c'est une belle reconnaissance de son travail, les auteurs valident spécifiquement le critère de Sgarbossa modifié par Smith, qui est considéré comme positif en cas de «surélévation du segment ST au point J, par rapport au début du QRS, d’au moins 1mm et d'une amplitude d’au moins 25% de l'onde S précédente». Cela augmente considérablement la sensibilité de la règle de la concordance inappropriée du 3e critère de Sgarbossa.11
Le SCA postérieur est précisément décrit comme un sous-décalage du segment ST horizontal dans les dérivations V1-V3 associé à une onde R prédominante en V2 (Rapport R/S >1), et qui peut être confirmé par la constatation d’un sus-décalage dans les dérivations complémentaires V7-V9.
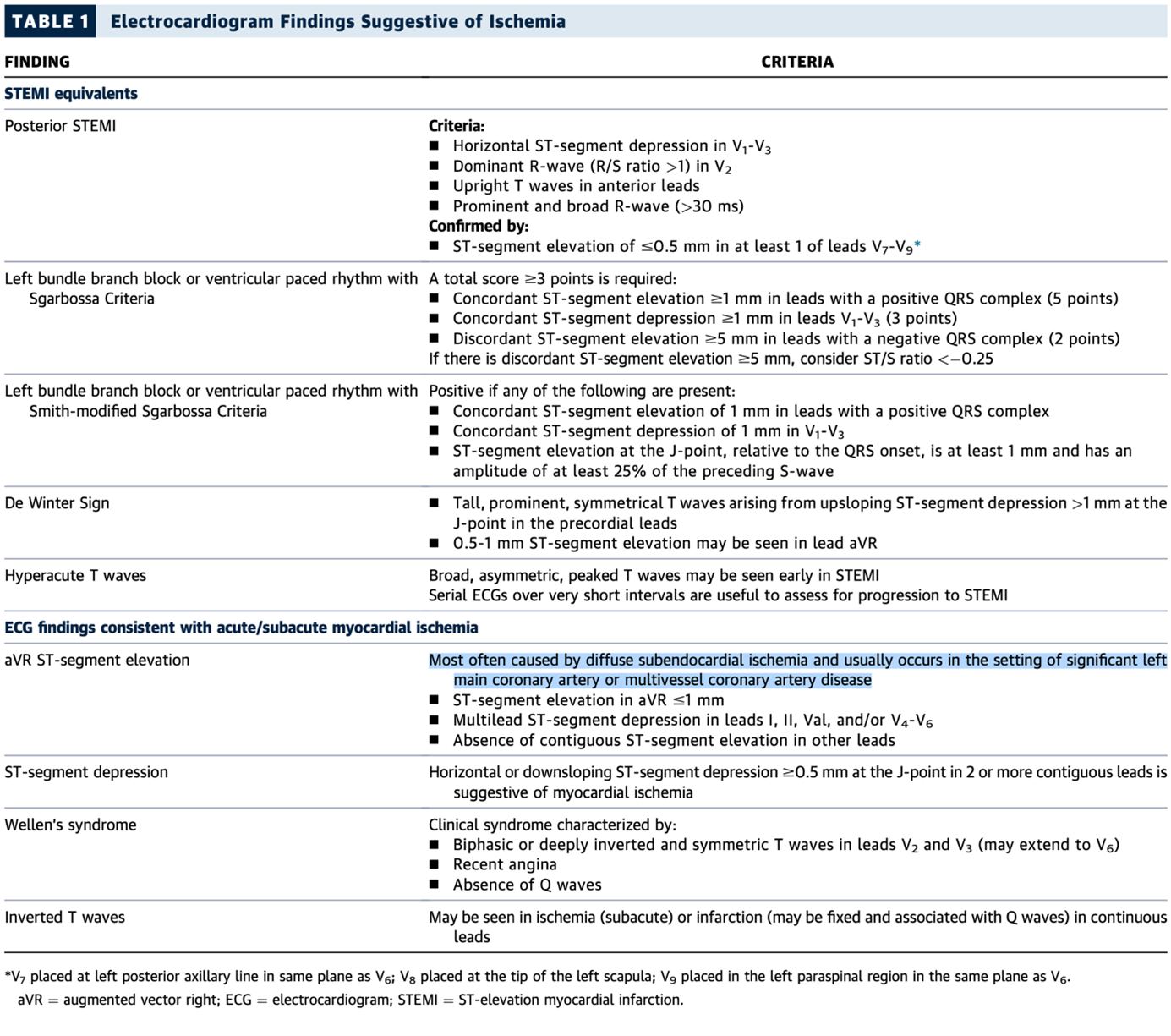
Aspects ECG en faveur d’une ischémie coronaire, d’après Kontos, et al. 3
D’autres résultats probants de l’ECG ischémique que j’enseigne depuis plusieurs années sont également mentionnés.
Le sous-décalage descendant du segment ST dans un territoire coronaire. Aspect le plus classiquement décrit, il est cependant rarement rencontré alors qu’il peut traduire une sténose serrée, voire une occlusion complète de l’artère touchée.
ECG 6 : ischémie sous-endocardique avec segment ST descendant diffus et signes d’occlusion de l’artère coronaire droite
(associée à un bloc atrio-ventriculaire complet)
Le syndrome de Wellens (ou syndrome de l’inter-ventriculaire antérieure)
Il doit être traité comme un SCA non-ST+ à très haut risque. Il est caractérisé par des inversions biphasiques (Type 1 ou A) ou inversées de l’onde T (Type 2 ou B) dans les dérivations précordiales antérieures chez les patients dont l’ischémie a été spontanément levée.
Sa présence est associée à une sténose serrée de l’artère inter-ventriculaire antérieure (IVA) proximale et est associée à un taux élevé d'infarctus transmural ultérieur (risque relatif d’occlusion complète multiplié par 8 dans les 7 jours).
ECG 7 : Syndrome de Wellens
(type 2 avec ondes T inversées)
Dernier aspect ECG marquant discuté dans ces recommandations, le sus-décalage du segment ST en aVR associé à un sous-décalage diffus dans les dérivations DI, DII, aVL, et/ou V4-V6.
Le plus souvent causée par une ischémie sous-endocardique diffuse, cette conformation ECG survient généralement dans le cadre d’une coronaropathie évoluée touchant le tronc de la coronaire gauche et/ou l’IVA proximale.
Cet aspect ECG, plus souvent retrouvé chez la personne âgée, est à haut risque car associé à une morbidité et une mortalité élevées. Chez les patients présentant des symptômes ischémiques, il s’agit souvent d’une ischémie diffuse due à une sténose significative du tronc commun gauche et/ou d’une atteinte tritronculaire.
Ce “pattern” peut être observé dans d’autres conditions que l’occlusion coronaire thrombotique car l'insuffisance coronarienne peut être provoqué par une inadéquation entre la demande et les besoins en perfusion coronaire, comme dans l’anémie ou la sténose aortique très serrée (infarctus de type 2).5
Cependant, dans environ 10% des cas, une occlusion coronaire aiguë est présente et associe le plus souvent un ST+ en aVR > 1 mm et un sous-décalage diffus horizontal.12
ECG 8 : Sus-décalage en aVR associé à un sous-décalage diffus,
traduisant une ischémie sous-endocardique sévère par occlusion à 95-99% du tronc commun.
Par conséquent, même si ces aspects ECG sont critiques, la prise en charge des patients présentant ce type de tracé ECG doit être nuancée : les étiologies non occlusives à l’origine d’un déséquilibre entre la demande et le besoin de perfusion coronaire doivent être éliminées ou traités si elles sont diagnostiquées.
Par ailleurs, si les symptômes ischémiques et/ou des modifications de l’ECG persistent après traitement de celles-ci, ou encore en cas d'instabilité hémodynamique, il est licite de proposer le patient à une exploration angiographique et de le traiter comme un SCA non-ST+.
En outre, si une coronarographie urgente doit être envisagée chez les patients présentant ces aspects, compte tenu de la prévalence importante de l’atteinte tritronculaire souvent plus accessible à la chirurgie par pontage coronarien que l’angioplastie coronaire, les prétraitements antithrombotiques doivent être administrés avec prudence avant le diagnostic angiographique.
Ainsi, on se limite le plus souvent à l’administration de l’aspirine en phase pré-procédurale afin de limiter d’éventuelles complications hémorragiques s’il s’agît d’effectuer un pontage en urgence.
Conclusion
Ces recommandations permettent de faire avancer notre pratique. Elles sont adaptées aux connaissances actuelles de la science de l’électrocardiographie de l’ischémie myocardique.
Cependant, elles mettent en évidence un problème majeur avec notre terminologie actuelle et la dichotomie entre le SCA ST+ et le SCA non-ST+. En effet, le SCA non-ST+ tel qu’il est défini couvre un éventail beaucoup trop large de patients.
Certains présentent de petites élévations de troponine et des ECG normaux : ils présentent en fait un risque assez faible. Pour eux, on peut se poser la question de la valeur d’un cathétérisme si un diagnostic antérieur a déjà été posé.
À l’opposé, un patient qui présente un syndrome de Wellens ou, a fortiori, des complexes de De Winter, possède un risque beaucoup plus élevé et a définitivement besoin d’une angiographie diagnostique et d’une angioplastie dans des délais courts.
C’est en cela que ces recommandations sont intéressantes. En effet, il n’y a aucune raison chez certains patients de retarder l’accès au cathétérisme et donc de se contenter de les prendre en charge selon des recommandations entourant le SCA non-ST+ qui sont à la fois trop vagues et pas assez directives.
Dans mon esprit, l’accent devrait être mis sur notre pratique clinique et la définition de la meilleure corrélation de l’ECG avec la physiopathologie de l’occlusion coronaire. On peut regretter qu’un chapitre équivalent ne soit discuté que dans les suppléments des recommandations européennes de l’ESC sur le SCA sans élévation du segment ST de 2020.13
Compte tenu du risque élevé d’occlusion coronaire aiguë, il faut supposer que ces aspects ECG nécessitent une coronarographie urgente en s’assurant bien sûr que l’histoire de la maladie et la présentation clinique sont cohérentes et qu’il n’existe pas d’autres causes à l’ischémie myocardique.
Retrouvez tous nos articles sur Twitter, LinkedIn et Facebook.
Vous êtes médecin ?
Pour recevoir une sélection de nos articles ou les commenter, il vous suffit de vous inscrire.
Références :
1- Meyers HP, Weingart S, Smith SW.
The OMI Manifesto. April 1st, 2018. EMCrit Podcast.
[download: https://drive.google.com/file/d/1fggo_ocVhEsIUVNPDQxNsmTiGV8MVlmm/view]
2- Aslanger EK, Yıldırımtürk Ö, Şimşek B, Bozbeyoğlu E, Şimşek MA, Yücel Karabay C, Smith SW, Değertekin M.
DIagnostic accuracy oF electrocardiogram for acute coronary OCClUsion resuLTing in myocardial infarction (DIFOCCULT Study).
Int J Cardiol Heart Vasc. 2020 Jul 30;30:100603.
3- Writing Committee, Kontos MC, de Lemos JA, Deitelzweig SB, Diercks DB, Gore MO, Hess EP, McCarthy CP, McCord JK, Musey PI Jr, Villines TC, Wright LJ. 2022
ACC Expert Consensus Decision Pathway on the Evaluation and Disposition of Acute Chest Pain in the Emergency Department: A Report of the American College of Cardiology
Solution Set Oversight Committee. J Am Coll Cardiol. 2022 Oct 6:S0735-1097(22)06618-9.
4- Whited JD, Grichnik JM.
The rational clinical examination. Does this patient have a mole or a melanoma?
JAMA. 1998 Mar 4;279(9):696-701.
5- Thygesen K, Alpert JS, Jaffe AS, Chaitman BR, Bax JJ, Morrow DA, White HD;
Executive Group on behalf of the Joint European Society of Cardiology (ESC)/American College of Cardiology (ACC)/American Heart Association (AHA)/World Heart Federation (WHF)
Task Force for the Universal Definition of Myocardial Infarction.
Fourth Universal Definition of Myocardial Infarction (2018).
Circulation. 2018 Nov 13;138(20):e618-e651.
6- Collet JP, Thiele H, Barbato E, Barthélémy O, Bauersachs J, Bhatt DL, Dendale P, Dorobantu M, Edvardsen T, Folliguet T, Gale CP, Gilard M, Jobs A, Jüni P, Lambrinou E, Lewis BS, Mehilli J, Meliga E, Merkely B, Mueller C, Roffi M, Rutten FH, Sibbing D, Siontis GCM;
ESC Scientific Document Group.
2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation.
Eur Heart J. 2021 Apr 7;42(14):1289-1367.
7- Chapman AR, Hesse K, Andrews J, Lee KK, Anand A, Shah ASV, Sandeman D, Ferry AV, Jameson J, Piya S, Stewart S, Marshall L, Strachan FE, Gray A, Newby DE, Mills NL.
High-Sensitivity Cardiac Troponin I and Clinical Risk Scores in Patients With Suspected Acute Coronary Syndrome.
Circulation. 2018 Oct 16;138(16):1654-1665.
8- Writing Committee Members, Gulati M, Levy PD, Mukherjee D, Amsterdam E, Bhatt DL, Birtcher KK, Blankstein R, Boyd J, Bullock-Palmer RP, Conejo T, Diercks DB, Gentile F, Greenwood JP, Hess EP, Hollenberg SM, Jaber WA, Jneid H, Joglar JA, Morrow DA, O'Connor RE, Ross MA, Shaw LJ.
2021 AHA/ACC/ASE/CHEST/SAEM/SCCT/SCMR
Guideline for the Evaluation and Diagnosis of Chest Pain: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines.
J Am Coll Cardiol. 2021 Nov 30;78(22):e187-e285.
9- Gongora CA, Bavishi C, Uretsky S, Argulian E.
Acute chest pain evaluation using coronary computed tomography angiography compared with standard of care: a meta-analysis of randomised clinical trials.
Heart. 2018 Feb;104(3):215-221.
10- O'Gara PT, Kushner FG, Ascheim DD, Casey DE Jr, Chung MK, de Lemos JA, Ettinger SM, Fang JC, Fesmire FM, Franklin BA, Granger CB, Krumholz HM, Linderbaum JA, Morrow DA, Newby LK, Ornato JP, Ou N, Radford MJ, Tamis-Holland JE, Tommaso JE, Tracy CM, Woo YJ, Zhao DX; CF/AHA Task Force.
2013 ACCF/AHA guideline for the management of ST-elevation myocardial infarction: executive summary: a report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines.
Circulation. 2013 Jan 29;127(4):529-55.
11- Dodd KW, Zvosec DL, Hart MA, Glass G 3rd, Bannister LE, Body RM, Boggust BA, Brady WJ, Chang AM, Cullen L, Gómez-Vicente R, Huis In 't Veld MA, Karim RM, Meyers HP 3rd, Miranda DF, Mitchell GJ, Reynard C, Rice C, Salverda BJ, Stellpflug SJ, Tolia VM, Walsh BM, White JL, Smith SW;
PERFECT study investigators (the complete list of PERFECT study investigators is provided in Appendix E1, available at http://www.annemergmed.com).
Electrocardiographic Diagnosis of Acute Coronary Occlusion Myocardial Infarction in Ventricular Paced Rhythm Using the Modified Sgarbossa Criteria.
Ann Emerg Med. 2021 Oct;78(4):517-529.
12- Harhash AA, Huang JJ, Reddy S, Natarajan B, Balakrishnan M, Shetty R, Hutchinson MD, Kern KB.
aVR ST Segment Elevation: Acute STEMI or Not? Incidence of an Acute Coronary Occlusion.
Am J Med. 2019 May;132(5):622-630.
13- Collet JP, Thiele H, Barbato E, Barthélémy O, Bauersachs J, Bhatt DL, Dendale P, Dorobantu M, Edvardsen T, Folliguet T, Gale CP, Gilard M, Jobs A, Jüni P, Lambrinou E, Lewis BS, Mehilli J, Meliga E, Merkely B, Mueller C, Roffi M, Rutten FH, Sibbing D, Siontis GCM;
ESC Scientific Document Group.
2020 ESC Guidelines for the management of acute coronary syndromes in patients presenting without persistent ST-segment elevation.
Eur Heart J. 2021 Apr 7;42(14):1289-1367.
[Supplementary Data available at : https://oup.silverchair-cdn.com/oup/backfile/Content_public/Journal/eurheartj/42/14/10.1093_eurheartj_ehaa575/7/ehaa575_supplementary_data.pdf?]
* Nicolas Peschanski est professeur de médecine d'urgence et praticien hospitalier au CHU de Rennes. Membre actif de longue date de la SFMU – avec six années passées au sein de la commission scientifique – il siège depuis 2020 à la commission des référentiels.
Le parcours international du Pr Peschanski, notamment aux USA, lui a permis de devenir membre de la Commission Internationale de l'American College of Emergency Physicians ainsi que du comité de pilotage de l'EMCREG-International (Emergency Medicine Cardiac Research and Education Group). Il fait également partie de l'Eusem (European Society for Emergency Medicine) et plus particulièrement de son comité «Web & social media».
Le Pr Peschanski est très attaché au principe de la FOAMed (Free Open Access Meducation - Partage en libre accès des ressources éducatives médicales). Il utilise les réseaux sociaux (@DocNikko) à des fins pédagogiques et de partage des connaissances en médecine d’urgence.
Liens d'intérêts
Le professeur Peschanski déclare les liens d'intérêts suivants :
- sur les trois dernières années : Vygon SA (consultant), Fisher&Paykel (symposium), AstraZeneca (symposium)
- sur les vingt dernières années :
Symposiums : Fisher&Paykel Healthcare , AstraZeneca, Lilly, Sanofi, Daiichi-Sankyo, HeartScape, The Medicine Company, Thermofisher, Roche Diagnostics
Boards : Bayer, AstraZeneca, Vygon SA, Portola USA, Sanofi, Boehringer Ingelheim
Congrès : Lilly, Sanofi, Vygon SA, Portola, Roche Diagnostics, Thermofisher
Fonds de recherche (non personnels) : Servier, Boehringer Ingelhei