L’hadronthérapie, une technologie de haute précision contre le cancer
Encore plus efficaces contre certaines tumeurs que les protons, les ions carbone permettent une irradiation à la fois massive et millimétrique.
Il existe trois techniques principales de traitement contre le cancer, utilisées seules ou conjointement : la chirurgie, la chimiothérapie et la radiothérapie. Cette dernière consiste à utiliser des rayonnements ionisants (principalement des faisceaux de rayons X ou d’électrons, mais parfois aussi des sources radioactives internes) dans les traitements locaux ou loco-régionaux des tumeurs cancéreuses. Le principe est de déposer la dose prescrite dans la zone tumorale en préservant au mieux les tissus sains environnants.
Toutefois, malgré les grandes avancées en termes de qualité et de conformation de faisceaux, certains types de tumeurs dites «radiorésistantes» (~2% des cas) ne peuvent pas être traitées par la radiothérapie conventionnelle.
L’hadronthérapie
Il existe une autre technique, de plus en plus prometteuse, pour traiter notamment ce genre de tumeurs radiorésistantes. L’hadronthérapie consiste à irradier les tumeurs, non plus à l’aide de faisceaux de rayons X (des photons) mais avec des particules chargées comme les protons ou encore des ions carbone. La grande différence entre les photons et ces noyaux d’atomes chargés est la manière dont ces deux types de particules vont déposer leur énergie dans le corps du patient.
Si la protonthérapie est assez connue – une centaine de centres la pratiquent dans le monde, dont trois en France –, la carbonethérapie est encore confidentielle. Théoriquement, le terme «hadronthérapie» englobe ces deux techniques. En pratique il désigne plus spécifiquement la seconde.
Une précision inégalée
Alors que les faisceaux de rayons X déposent de l’énergie tout au long de leur parcours, depuis l’entrée du corps du patient jusqu’à sa sortie, les particules chargées (protons ou ions carbone) ne pénètrent quant à elles que jusqu’à une certaine profondeur puis elles s'arrêtent. Cette profondeur varie selon l’énergie du faisceau et les matériaux traversés.
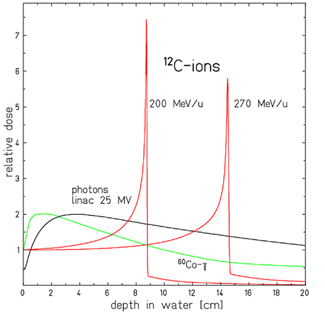
Comparaison de différents profils de dépôt de dose pour 2 faisceaux d’ions carbone d’énergie différente (en rouge) ainsi que 2 faisceaux de rayons X (en vert et noir).
D. Schardt et al., Reviews of Modern Physics, 82 (2010), 383
De plus, le dépôt d’énergie des faisceaux de rayons X se fait de manière continue, suivant un profil légèrement décroissant avec la profondeur (un faisceau unique dépose donc plus d’énergie près de la surface que dans la tumeur, en profondeur. Pour leur part, les particules chargées déposent très peu d’énergie tout au long de leur parcours. Mais leur interaction avec le matériau traversé est caractérisée par un pic de dépôt d’énergie (appelé «Pic de Bragg») près de l’endroit où elles s’arrêtent. Parce que la dispersion spatiale et en énergie des ions carbone est plus faible que celle des protons, à profondeur équivalente le pic de Bragg obtenu par carbonethérapie est encore plus fin qu'avec la protonthérapie.
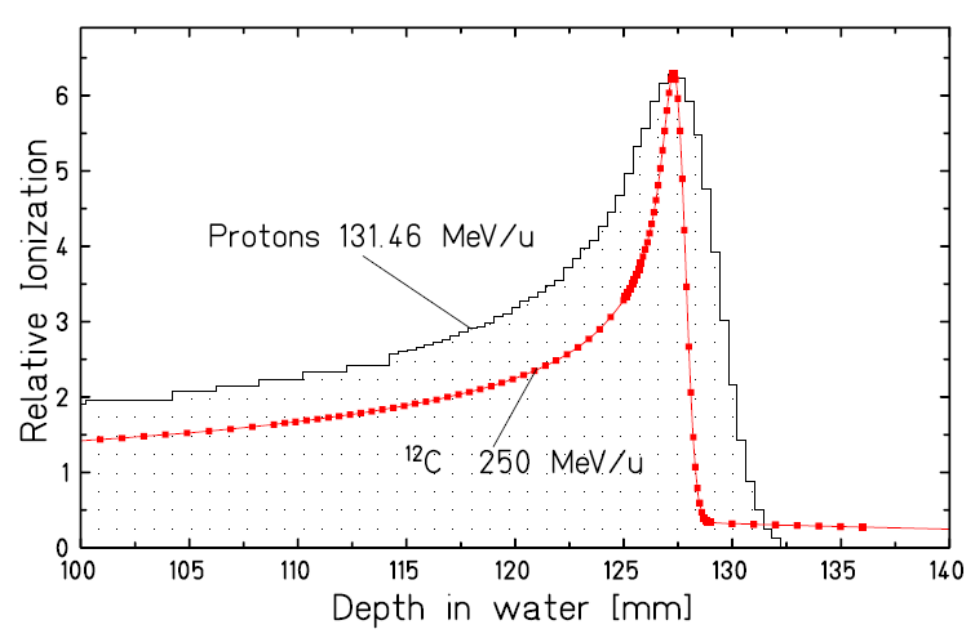
Comparaison de la largeur du Pic de Bragg pour un faisceau d'ions carbone et un faisceau de protons de même parcours. Le pic de Bragg du faisceau de protons est environ trois fois plus large.
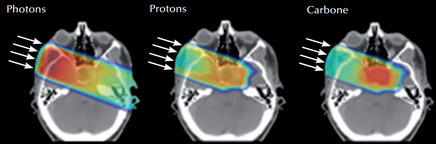
On voit rapidement l’intérêt balistique d’une telle irradiation, capable de réduire considérablement le dépôt d’énergie dans les tissus amont, de quasiment l’annuler dans les tissus aval et de maximiser le dépôt de dose à la profondeur précise où se situe la tumeur.
©GCS ETOILE
Effet d’un seul faisceau d’irradiation en rayons X (à gauche), en protonthérapie (au milieu) et en hadronthérapie carbone (à droite). La tumeur est au centre du crâne.
Avantages et limites
L’hadronthérapie est tout d'abord particulièrement indiquée dans le cas de tumeurs radiorésistantes comme le cholangiocarcinome nodulaire unique ou l’adénocarcinome du pancréas. Paradoxalement, ces tumeurs peuvent être très sensibles à cette nouvelle modalité d’irradiation, qui est alors utilisée en complément de la radiothérapie classique.
L’un de ses autres avantages est sa précision balistique. Non seulement le faisceau de particules s’arrête dans la tumeur, épargnant totalement les tissus en aval, mais ce faisceau est aussi très fin, bien plus qu’un faisceau de rayons X. Cela impose d’ailleurs de le déplacer au cours de l’irradiation pour irradier point par point tout le volume de la tumeur. Une telle précision est précieuse lorsqu’il s’agit de traiter des tumeurs positionnées très près de tissus sains radiosensibles, comme les tumeurs de la colonne vertébrale et para-rachidiennes : sarcomes, chordomes inopérables ou incomplètement réséqués.
De plus, les résultats publiés concernant l'irradiation par ions carbones montrent une efficacité très largement au-dessus des valeurs des traitements non-carbone. Ces résultats concernaient des adénocarcinomes de la tête et du cou, des mélanomes muqueux, des chordomes, sarcomes, hépatocarcinomes et rechutes pelviennes d’adénocarcinomes du rectum. Enfin, l'utilisation de la carbonethérapie permet de réduire le nombre de séances nécessaires (d'après l'expérience italienne, un traitement avec des protons comporte 35 séances en moyenne, contre 16 avec des ions carbone).
©GSI
Illustration de la technique de «raster scanning» permettant de traiter tout le volume tumoral en faisant varier la position x,y,z du pic de Bragg.
Une limite de l'hadronthérapie est qu'elle ne permet pas de suivre en temps réel une tumeur en mouvement, dont la position change au rythme de la respiration du patient (poumons, foie, pancréas, etc.). Une solution consiste à faire passer au patient, en amont, un scanner 4D (la quatrième dimension étant le temps de la respiration). Il s'agit de «photographier» l'oscillation de la tumeur pendant l'inspiration et l'expiration. Pendant le traitement, des caméras infrarouges suivent la tumeur grâce à des capteurs placés sur le patient et le faisceau n'est activé que lorsque la tumeur se trouve dans la position où elle peut être atteinte.
Mais l'inconvénient majeur est bien sûr d'ordre logistique. L’hadronthérapie par ions carbone nécessite de devoir construire un accélérateur de particules qui jouxte le centre de traitement. Un élément mobile est aussi nécessaire, afin de tourner autour du patient tout en maintenant des précisions millimétriques. Un équipement d'une telle envergure est évidemment un sacré défi, au vu de l'encombrement, des difficultés techniques et des investissements requis.
Le coût explique en partie le faible nombre de centres de traitement par ions carbones. À ce jour, seuls quatre centres d’hadronthérapie carbone sont ouverts en Europe : deux en Allemagne (Heidelberg Ion-beam Therapy center et Marburg Particle Center), un en Autriche (MedAustron à Wiener Neustadt) et enfin le CNAO (Centro Nazionale di Adroterapia Oncologica) en Italie.
©CNAO
Le synchrotron du CNAO, situé dans un bunker de 1.600 m2 , est séparé du reste du bâtiment par un blindage anti-radiations en béton armé de 2 à 6 mètres d'épaisseur.
Les protons et ions carbone sont isolés par des champs magnétiques avant de subir une première accélération dans la partie linéaire (6 mètres de long, en rose). Puis ils «tournent» dans le synchrotron (80 mètres de circonférence), d'abord à raison de 30.000 kilomètres par seconde puis deux fois plus vite. Les particules sont ensuite envoyées dans les trois salles de traitement.
©GSI
Tout aussi impressionnante, la «Gantry» rotative (bleue) à Heidelberg. Elle soutient une partie de l’accélérateur d’ions carbone (orange), permettant au faisceau de tourner autour du patient dans la salle de traitement (non visible ici).
Technique innovante, l'hadronthérapie à ions carbone est très efficace pour traiter des tumeurs radiorésistantes, à la géométrie complexe ou mal positionnées dans le corps du patient. Toutefois, son extrême technicité est un frein majeur à son développement. Si le Japon, pays pionnier dans ce domaine, possède déjà sept centres de traitement par carbonethérapie, la France en est encore cruellement dépourvue.