Inhalation d’interféron contre la Covid-19 : enthousiasme et interrogations
Les résultats préliminaires d’une étude britannique suggèrent que l’inhalation d'interféron à l'aide d'un nébuliseur réduit le nombre de patients Covid-19 nécessitant des soins intensifs. La communauté scientifique salue ces résultats mais attend la publication de l’étude complète pour dissiper certaines réserves.
Les résultats préliminaires d’une étude suggèrent que l’inhalation d'interféron réduit le nombre de patients Covid-19 nécessitant des soins intensifs. La protéine, inhalée à l'aide d'un nébuliseur, stimule la réponse immunitaire. La communauté scientifique salue ces résultats mais attend la publication de l’étude complète.
La société britannique Synairgen vient d’annoncer les résultats de son essai chez des patients Covid-19 hospitalisés de la formulation brevetée SNG001. Il s'agit d'interféron bêta par inhalation.
Les interférons (IFN) sont des protéines libérées par les cellules en réponse à des infections virales. Le déficit dans la libération d'IFN-bêta par les poumons est impliqué dans la susceptibilité accrue de certains patients à développer une pneumonie grave suite à une infection des voies respiratoires. En outre, de nombreux virus ont développé des mécanismes qui suppriment la production endogène d'IFN-bêta afin de contourner la réponse du système immunitaire.
L’essai de phase II en double aveugle contrôlé par placebo baptisé SG016 a recruté 101 patients dans 9 hôpitaux du Royaume-Uni entre le 30 mars et le 27 mai 2020. D’après Richard Marsden, PDG de Synairgen, les premiers résultats montrent que les patients prenant le SNG001 avaient :
- 79% moins de risques de développer une forme grave de la Covid-19 que ceux sous placebo (OR 0,21 [95% CI 0,04-0,97] ; p=0,046),
- plus de deux fois plus de chances de se rétablir au point où leurs activités quotidiennes n'étaient plus compromises (notamment une réduction significative de l’essoufflement).
La proportion de sujets ayant obtenu un score de 0 (aucune preuve clinique/virologique de l'infection) ou de 1 (ambulatoire, aucune limitation des activités normales) sur l'échelle spécifique de l'OMS pour évaluer l'efficacité des traitements était également significativement plus élevée pendant la majeure partie de la période post-traitement chez les patients recevant l'interféron. Environ 60% des sujets sous interféron atteignaient ce résultat au 28e jour, contre environ 30% des sujets sous placebo.
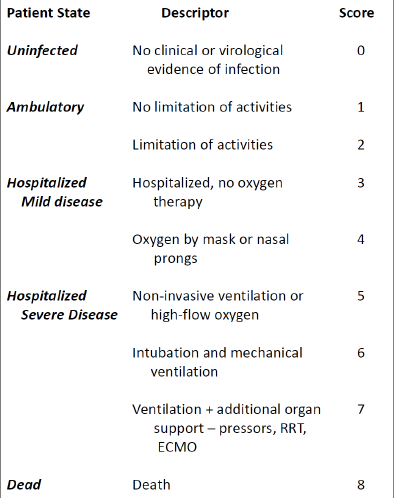
WHO Ordinal Scale for Clinic Improvement
(Covid-19 therapeutic trial synopsis)
Tom Wilkinson, professeur de médecine respiratoire à l'université de Southampton, a participé à cet essai. Il est enthousiaste : «Nous sommes ravis des résultats positifs de cette expérience, qui est le fruit d'un important effort conjoint de Synairgen, de l'université de Southampton, de l'hôpital universitaire de Southampton, du NHS Foundation Trust et des équipes de recherche du réseau National Institute for Health Research au Royaume-Uni. Les résultats confirment notre conviction que l'interféron bêta - un médicament largement connu, administré par injection et approuvé pour un certain nombre d'autres indications - a un potentiel énorme sous la forme inhalée afin de rétablir la réponse immunitaire dans les poumons et d’accélérer la récupération face au SRAS-CoV-2».
Le professeur Dave Singh, professeur de pharmacologie clinique et de médecine respiratoire à l'université de Manchester, a réagi à cette annonce : «En tant que concept scientifique, l'utilisation du SNG001 pour augmenter les niveaux d'interféron bêta dans le traitement du Covid-19 est tout à fait logique. Il s'agit d'une étude de phase 2 dans laquelle un nombre limité de patients sont recrutés en vue d’acquérir rapidement des données suffisantes pour analyser si le médicament a des effets bénéfiques.
Dans ce type d'études, nous examinons généralement l'ensemble des résultats, plutôt que de nous concentrer uniquement sur le paramètre principal ; cela nous permet de voir si les effets sont cohérents ou s'il s'agit d'artefacts éventuellement causés par la petite taille de l'échantillon. Il est extrêmement encourageant de constater des résultats positifs pour plusieurs paramètres, et pour le sous-groupe de personnes le plus gravement touchées qui avaient besoin d'oxygène lors de leur hospitalisation. Le résultat le plus important semble être la réduction du nombre de patients nécessitant une ventilation. La prudence s'impose jusqu'à la publication complète des données, mais ces résultats suggèrent que l'interféron bêta mérite d'urgence une évaluation plus approfondie en tant que traitement pour la Covid-19».
Des réactions mitigées
D'autres médecins apparaissent plus prudents. Ces experts s’accordent à dire que l’étude présente des points forts - elle est randomisée avec un contrôle placebo - et que les résultats annoncés sont prometteurs. Cependant ils émettent plusieurs réserves et attendent avec impatience les clarifications qu'apportera la publication de l'étude intégrale reviewée.
Penny Ward, professeure de pharmacologie invitée au sein du King's College de Londres, souligne que ces résultats sont encore très partiels : «Les données présentées sont des informations préliminaires basées uniquement sur les patients hospitalisés. Une étude parallèle recrute des patients Covid-19 traités à domicile.»
Par ailleurs, elle évoque d’éventuels biais «Les caractéristiques des patients dans chaque bras montrent que la proportion de patients atteints de diabète était trois fois plus élevée dans le bras placebo (9/50 - 18%) que chez les patients prenant de l'interféron (3/48 - 6,3%). On observe également un déséquilibre dans la proportion de patients atteints de maladies cardiovasculaires dans le groupe placebo (8/50 - 16 %) par rapport au groupe interféron (5/48 - 10,4 %). Ces différences ont pu affecter les résultats, bien que la société ait déclaré lors d'une conférence de presse que l'analyse avait été ajustée en fonction des facteurs de risque sous-jacents.»
Enfin, Penny Ward attend des éclaircissements. «Le principal résultat rapporté par la société a mis en évidence une réduction d’environ 79% du nombre de décès et/ou besoin d'assistance respiratoire au cours des 16 premiers jours de l'étude. Cependant, seul le nombre de décès a été donné (3 patients, tous sous placebo). La société a déclaré que cette différence a également été détectée le 28e jour, mais n'a pas fourni le nombre de patients ayant obtenu ces résultats dans les deux bras.»
Pour elle, les résultats de l'étude et les méthodes statistiques utilisées pour comparer les résultats doivent maintenant être publiés intégralement, pour permettre à la communauté scientifique de les examiner en détail.
Même prudence pour Martin Landray, professeur de médecine et d'épidémiologie à l'université d’Oxford, qui soulève un autre point : «L’échantillon est trop petit pour tirer des conclusions définitives. La réduction globale de la progression vers la maladie grave s'accompagne d'une énorme incertitude statistique (…) Il y a une grande différence entre des résultats précoces encourageants et des preuves définitives qui transforment la pratique clinique. Un essai randomisé beaucoup plus important est nécessaire pour évaluer si ce traitement a réellement un impact sur des résultats cliniques majeurs, dont la survie.»
Le professeur Steve Goodacre, professeur de médecine d'urgence à l'université de Sheffield, pointe des différences observées entre le projet initial et les résultats présentés : l’étude devait compter 400 participants, mais le communiqué de presse n’en indique que 101. Steve Goodacre se demande si l'essai a été arrêté prématurément, et si oui pour quelle raison. «Arrêter un essai dès qu'un traitement semble efficace peut être assimilé à arrêter une course et déclarer votre cheval vainqueur dès qu'il prend la tête (…) Ils auraient pu facilement inclure un lien vers le protocole de l'essai dans leur communiqué de presse. Je suis inquiet qu'ils ne l'aient pas fait » observe-t-il.
Le professeur Stephen Evans, professeur de pharmaco-épidémiologie à la London School of Hygiene & Tropical Medicine s’interroge sur la durée de l’essai : «Le principal résultat de cette étude (tel que décrit dans le protocole d'essai) devait être une échelle ordonnée pour l'amélioration clinique, mesurée sur les 14 jours pendant lesquels un patient a reçu un traitement (…) ». Or, si le communiqué de presse porte sur ce résultat, il évoque une période de traitement du jour 1 au jour 16.
Le Pr Evans insiste aussi sur l’indispensable évaluation des effets indésirables éventuels, rappelant que la microangiopathie thrombotique est une complication rare mais grave associée à la forme injectable du médicament. Une vigilance accrue quant à la forme inhalée est indispensable au vu des problèmes de coagulation déjà associés à la Covid-19.
Enfin, Stephen Evans relève lui la question de l’ambulatoire : «Le traitement est destiné aux personnes qui se trouvent à un stade très précoce de leur maladie, dans les 24 heures suivant leur test positif pour le virus du SRAS-CoV-2. Il était prévu que les patients puissent être traités à la fois à domicile et à l'hôpital, mais le communiqué de presse ne fait référence qu'aux patients hospitalisés. Il n'est pas clair si les données rapportées constituent un sous-groupe ou si elles n'ont pas recruté suffisamment de patients pour être traités à domicile.»
Ce même Pr Stephen Evans conclut par un appel à la prudence. «Il faut ici garder à l'esprit l'adage selon lequel "il faut se méfier des petites études qui revendiquent de grands avantages" (...) Ces résultats, bien qu'encourageants, ne doivent pas être considérés comme signifiant que le traitement est si spectaculaire qu'il devrait être administré à tout le monde.»
Vous êtes médecin ?
Pour recevoir une sélection de nos articles ou les commenter, il vous suffit de vous inscrire.
Références :
- Synairgen announces positive results from trial of SNG001 in hospitalised COVID-19 patients.
Synairgen Press Release - 20/07/2020.
- Expert reaction to announcement by Synairgen that their drug SNG001 has had positive results in initial trials on COVID-19 patients.
Science Media Centre - 20/07/2020