Aspects physiopathologiques du Covid-19 (Luciano Gattinoni, anesthésiste-réanimateur)
Le professeur Luciano Gattinoni est l’un des plus grands experts en anesthésie et réanimation. Il nous fait part de ses observations sur le Covid-19 et sa prise en charge : physiopathologie, clinique, décubitus ventral pour patients non intubés, "médecine de guerre"...
Le professeur Luciano Gattinoni, professeur émérite des universités de Milan et de Göttingen (Allemagne) est l’un des plus grands experts en anesthésie et réanimation. Il nous décrit certains aspects physiopathologiques et cliniques des patients atteints de COVID-19.
Quelle est la physiopathologie des lésions pulmonaires dues au COVID-19 ?
Je pense que les problèmes majeurs se situent au niveau vasculaire. Plusieurs collègues m'informent en effet de la présence de nombreuses cellules endothéliales dans le sang. Pourquoi dis-je qu'il s'agit d'un problème vasculaire ? C'est très simple. Ces patients - dans la phase initiale de la maladie - sont caractérisés par une extraordinaire dissociation entre la quantité de gaz dans les poumons, c'est-à-dire l'élasticité pulmonaire et l'hypoxémie artérielle.
Normalement, en cas d'insuffisance respiratoire aiguë (que nous considérons comme un SDRA), une faible compliance pulmonaire est associée à une hypoxie. Une dissociation de ce genre est très rare. En 40 ans d'activité, je n’en avais presque jamais vue. Ces patients avec une compliance presque normale présentent une hypoxémie monstrueuse, avec des valeurs de PaO2 de 35-40 mmHg et une saturation de 65-70%.
Quelle est l’explication de ce phénomène ? L'échange de gaz est une question de mathématiques, pas de suppositions. Chez ces patients, nous avons essentiellement une énorme altération du rapport ventilation/perfusion. La régulation du flux pulmonaire disparait, le flux devient majoritairement gravity dependent. Le flux sanguin et la ventilation suivent donc deux voies différentes.
À ce stade, le poumon n'a pas encore de zones affaissées. À l'imagerie, nous voyons certains aspects de ground-glass. Ils sont principalement au niveau capillaire, là où la contrainte est plus forte lors de la ventilation pulmonaire. Au-dessous de la plèvre, entre la plèvre et les alvéoles, il y a des différences d'élasticité, de sorte que nous avons une concentration de pressions et un étirement pulmonaire spécifiques dans zones (ce sont les premiers dommages visibles à la radio). C’est l’aspect ground-glass, qui résulte d'un œdème modeste et très localisé.
Comment le patient réagit-il à l'hypoxie ? Lorsque les niveaux de 40-50 mmHg sont atteints, nos centres respiratoires commencent à augmenter le volume courant. Imaginez donc que vous respirez deux fois plus que la normale, ce qui augmente votre volume actuel de 30 à 40%. Cela se produit sans dyspnée : comme la compliance est très bonne, lorsque le patient augmente le volume courant, il fait certes un certain effort musculaire, mais cet effort musculaire correspond au sentiment de remplissage qu'il attend, donc il n'a pas de dyspnée. Lorsqu'un sportif court, il n'a pas de dyspnée. La dyspnée se produit lorsqu'un certain effort musculaire est fait pour aspirer de l'air, que le cerveau attend une certaine sensation de remplissage, mais que l'air n'arrive pas.
En faisant ces efforts, au fil du temps le volume courant augmente. L'augmentation des pressions négatives dans la plèvre attire davantage de sang au niveau central, ce qui augmente la filtration dans un poumon enflammé, et augmente l'œdème. À cause de cet œdème, le poumon est comme une éponge mouillée : il devient plus lourd et a tendance à s'affaisser sur lui-même.
À l'imagerie on voit de plus en plus de ground-glass, et on commence à voir des zones complètement blanches, dans les bases. C'est l'effet de l'écrasement du poumon. À ce stade, l'évolution de la maladie entraîne une aggravation de l'état du patient. Même si le réanimateur est capable d'équilibrer la PaO2 en l'augmentant, ces patients sont caractérisés par un "drive respiratoire" beaucoup plus important. Je pense que cela est lié à l'infection virale, mais nous ne savons toujours pas quel est le mécanisme.
L'évolution de la maladie est donc due non seulement à la gravité de l'infection, mais aussi à des facteurs mécaniques. C’est lorsque le patient présente une grande dyspnée, que le CT-scan montre une grave déficience pulmonaire - et pas avant - que le patient passe en SDRA.
L’erreur, à mon avis, serait de traiter d’emblée un patient qui se présente avec une hypoxémie sévère comme s'il avait un SDRA. C'est une erreur majeure, avec des conséquences importantes. Chez un patient atteint de SDRA, il faut maintenir les paramètres stables dans l'unité de soins intensifs et attendre que la tempête passe. Je pense que le taux de mortalité dans l'unité de soins intensifs de ces patients ne devrait pas dépasser 15 à 20%. Actuellement, il est beaucoup plus élevé, je crains qu'il ne soit d'environ 40%, parce que nous ne sommes pas en mesure de traiter les patients comme nous le devrions.
Il s'agit de patients qui sont admis aux soins intensifs tardivement, peut-être après 4 jours de ventilation non invasive, de CPAP, etc. Il s'agit de patients sur lesquels on essaie d'administrer des traitements sans preuves scientifiques solides. La médecine ne se fonde pas sur des anecdotes (en particulier celles qui circulent sur Internet), mais sur des preuves. Sans preuve scientifique, l'administration d'un médicament n'a pas beaucoup de sens.
Dans un contexte de ressources limitées, quel est le bon critère pour l’hospitalisation ?
Nous devrions mesurer l'effort inspiratoire, la négativité de la pression pleurale que le patient présente à ce moment. Si le patient a une pression pleurale très négative, qui dépasse 12-15 cmH2O alors nous sommes sûrs - car nous disposons de nombreuses preuves expérimentales - qu'un poumon sain est détruit en 24-48 heures.
Si un patient dyspnéique se présente, je mesure immédiatement la pression avec un ballonnet oesophagien. Ou bien j’examine la mécanique respiratoire : la contraction du sternocleidomastoïde, les mouvements diaphragmatiques et intercostaux, ceux de l’abdomen. J’évalue aussi les variations de la pression veineuse centrale, qui vont de pair avec les variations de la pression pleurale, j'utilise l'échographie pour analyser les mouvements du diaphragme. Nous avons plusieurs manières de quantifier l'effort respiratoire.
À ce stade, lorsque j'évalue la présence d'un effort respiratoire excessif, je peux essayer d'utiliser un casque CPAP. Supposons que nous mettions le CPAP à 15 cmH2O. Pour certains patients, l'effort respiratoire diminue, de sorte que le cercle vicieux qui conduit à l'aggravation est rompu. Mais pour d'autres ce n'est pas le cas, car l'effort respiratoire peut ne pas diminuer et rester très élevé. De plus, avec une pression de 15 cmH2O, le ventricule droit risque de se bloquer.
En fait, la pression positive entraîne des problèmes hémodynamiques. Les patients peuvent devenir instables, on leur donne de la noradrénaline, avec le risque qu'après 24 heures ils présentent une insuffisance rénale. À ce stade, il faut bien sûr procéder à une intubation, installer un respirateur, etc.
Par manque de ressources, des patients ont été assistés avec des méthodes non invasives (CPAP, VNI). Qu’en pensez-vous ?
J'ai du mal à répondre à cette question. Dans cette situation, j’ai envie de dire que le tout est de faire quelque chose : casque CPAP, 10-15 cmH2O de PEEP et voyons comment ça se passe... Mais ce n'est pas de la médecine, c'est de la médecine de guerre, dans laquelle vous pouvez également utiliser des scores pour décider quels patients méritent d'être traités et lesquels ne le méritent pas. La médecine, c'est autre chose.
Par manque de médecins et de soignants, il n'est plus possible de ciseler comme on le fait habituellement en soins intensifs...
Mes collègues font d'énormes efforts pour gérer cette situation, en Italie et ailleurs. Nous n'avons pas de médicaments, pas de lits, pas de temps. Normalement une unité de soins intensifs a besoin d'une infirmière pour deux patients. Là où avant on en traitait 10 patients, on en traite 40, avec le même nombre de médecins et d’infirmières. Il ne s'agit plus de soins intensifs. 1 médecin pour 10 patients n'est pas un service de soins intensifs.
Traiter un patient ne se fait pas avec juste un lit et un respirateur. Vous avez également besoin de quelqu'un qui puisse consacrer le temps nécessaire au patient, et qui sache comment le faire. Ce ne sont pas des choses qui peuvent s'improviser en deux semaines. Mais les personnels des soins intensifs sont habitués aux situations critiques, aux patients qui ne réagissent pas au traitement, aux évolutions brutales.
Le vrai problème, à mon avis, se situe en dehors des soins intensifs, dans les unités dites sous-intensives où, par nécessité, travaillent des médecins qui font habituellement autre chose (voir notre article Il s'appelle Nicolas). Nous avons des médecins qui savent maintenant ce qu'est un CPAP, qui l'utilisent sans en connaître les mécanismes. Imaginez ce qui se passerait s'ils me disaient demain d'aller au bloc opératoire pour opérer une fracture du fémur. Il ne s'agit pas de médecine, je le répète.
La technique de la position allongée sur le ventre pour des patients en respiration spontanée et/ou des patients CPAP se répand. Est-ce réellement bénéfique ?
À la Polyclinique de Milan, nous avons été parmi les premiers à introduire cette position. Dans la littérature, nous avons ensuite découvert qu'il n'y avait qu'un seul article anecdotique datant de 1972 dans lequel une médecin rapportait qu'elle avait mis des patients sur le ventre et constaté une amélioration de l’oxygénation.
En examinant les scanners pulmonaires de patients atteints d'insuffisance respiratoire aiguë en décubitus dorsal, nous avons constaté que dans les zones du poumon plus proches des vertèbres toutes les lésions étaient inter-dépendantes. En décubitus ventral, le poumon entier ne semblait pas aussi compromis. À la radio, par contre, on ne voyait pas cette différence.
À l’époque, nous avons naturellement décidé de mettre les patients sur le ventre, et nous avons remarqué que l'oxygénation augmentait. Nous pensions que l'augmentation de l'oxygénation était motivée par le déplacement du flux dans les parties du poumon de plus faibles densités - observables au scanner - que nous avons appelé baby lung.
En décubitus ventral, nous avons été surpris de constater au scanner une augmentation de la densité au niveau du sternum. Ainsi est né le modèle, encore valable, d'un poumon en forme d’ «éponge». Imaginez une éponge sèche avec des pores d'une certaine taille : vous la mettez dans l’eau, la sortez, et la posez sur le bord de la baignoire. Vous verrez que les pores du bas diminuent de volume parce qu'ils sont écrasés par le poids de l'éponge. Quand le patient est sur le ventre, c'est comme si le poumon était contraint d’expulser l’air par sa partie postérieure.
En libérant les parties postérieures du poumon - qui étaient auparavant écrasées - et en comprimant un peu les parties antérieures, la perfusion reste uniforme (contrairement à ce que nous pensions auparavant). Nous avons de cette façon une plus grande partie du poumon «ouverte», ce qui augmente l'oxygénation. C'est le mécanisme principal, mais il y a aussi 2 ou 3 autres mécanismes mineurs.
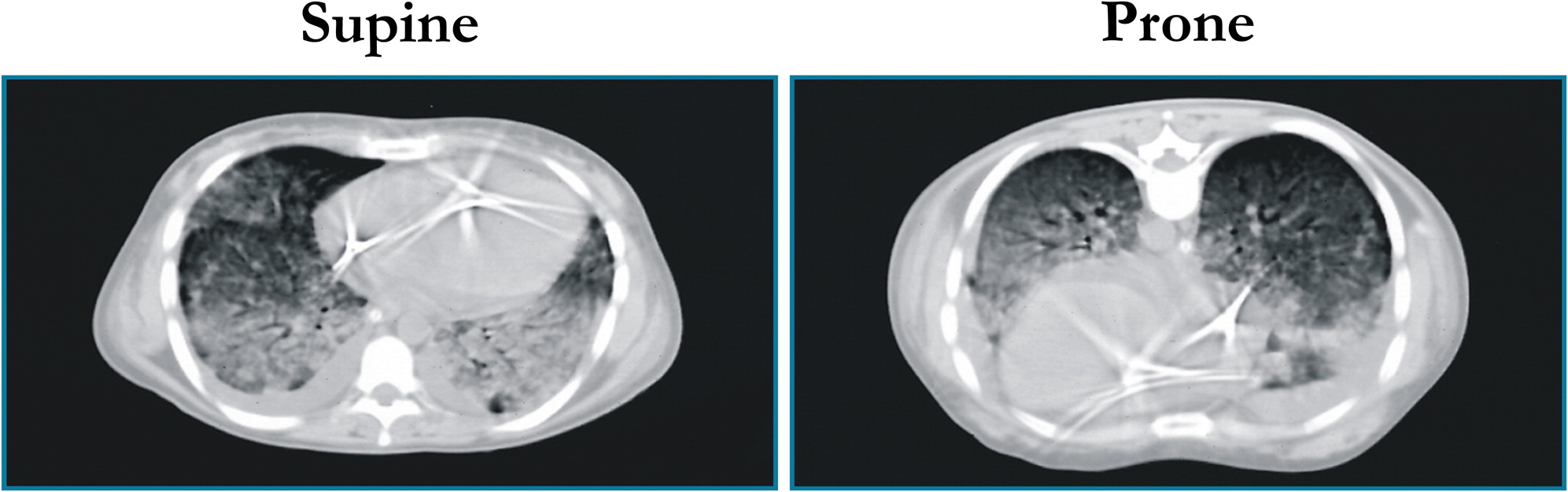
CT-scan d'un patient atteint de SDRA
couché sur le dos (à gauche) et sur le ventre (à droite)
Les patients atteints de COVID-19 dans les premiers stades ne présentent pas d'œdème, c'est-à-dire un poumon ressemblant à une grosse éponge remplie d'eau. Dans la phase initiale, il y a simplement une modification du rapport ventilation/perfusion. En mettant ces patients en position couchée, nous avons des bénéfices grâce au premier mécanisme que j'ai décrit. Comme la perfusion a tendance à être gravitationnelle, lorsque nous plaçons les patients sur le ventre, nous plaçons la partie non dépendante du poumon, c'est-à-dire la plus grande masse du poumon, dans des conditions de perfusion plus favorables.
Ainsi, avec un mécanisme différent, le résultat final est le même. Évidemment, si la situation s'aggrave et que l'œdème commence à augmenter, lorsque le poumon devient une belle éponge, la position sur le ventre est avantageuse grâce au deuxième mécanisme.
C’est ce que nous voyons au CT-scan : il existe deux stades de la maladie. Dans la première phase, les patients ont des poumons «L-light» (compliance élevée, V/Q faible) : chez ces patients, le poumon ne pèse pas autant, donc il n’y a pas cet effet d'éponge. Dans une seconde phase, les poumons deviennent «H-heavy» (l’image est alors proche de celle du SDRA) et on observe une redistribution des densités comme dans le SDRA classique. Les toutes premières données dont nous disposons vont dans ce sens.
Quand faut-il extuber un patient COVID-19 ?
Faut-il privilégier le maintien en soins intensifs ou le passage en pneumologie ou réadaptation ?
L'extubation n’est possible que lorsque, à la diminution de l'assistance, les patients ne présentent pas un drive respiratoire terrifiant. S’ils sont capables de respirer de manière adaptée, ils peuvent bien sûr être sevrés.
Le séjour moyen en soins intensifs est d'environ dix jours pour les patients qui s’améliorent, et autant pour ceux dont l'état s'aggrave jusqu'à la mort. Nous avons un troisième groupe de patients, environ 60%, dont l'évolution est incertaine. Pour eux, nous avons besoin de beaucoup plus de temps en soins intensifs.
Dans cette pathologie, la chose dont nous avons besoin, c’est la patience. Une amélioration de l'échange gazeux, qui peut se produire même rapidement, ne doit pas être compensée par l’arrêt du ventilateur. L'état du patient n'a certainement pas changé. Il faut attendre que la maladie suive son cours. L'une des choses les plus difficiles en soins intensifs, c’est de ne rien faire. Mais c'est ce qu'il faut faire chez ces patients.
Ces patients, il faudrait tous les garder en soins intensifs, car en Italie ce sont les réanimateurs qui ont la plus grande expertise dans la gestion des patients atteints d'une grave infection pulmonaire.